انرژي يونش چيست؟ - روند تغييرات انرژي يونش
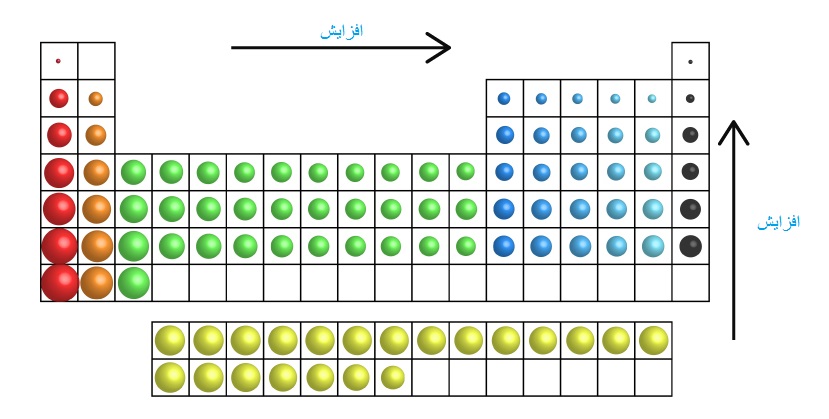
در يك گروه با افزايش عدد اتمي بار موثر هسته افزايش مييابد، اما اين اثر با افزايش تعداد الكترونهاي داخلي كه اثر پوششي دارند، كاسته ميشود و با افزايش تعداد لايههاي الكتروني و قرار گرفتن الكترونها در فاصله دورتري نسبت به هسته الكترون ظرفيت آسانتر جدا ميشود و به انرژي كمتري نياز دارد. به ترتيب در انرژيهاي يو نش بعدي بر تعداد بار مثبت كاتيون اضافه شده و ميزان جاذبه بار مثبت و الكترونها افزوده شده و نيروي دافعه بين الكترونها كمتر خواهد بود و انرژي مصرفي براي جدا كردن الكترون بالاتر خواهد بود. اين الكترون اضافي نسبت به نيتروژن در يكي از اين اوربيتالها به صورت جفت شده وجود دارد كه دافعه بين آنها باعث ميشود انرژي كمتري براي جدا كردن آنها مصرف شود تا به حالت پايدار سه تايي مثل نيتروژن برسند.
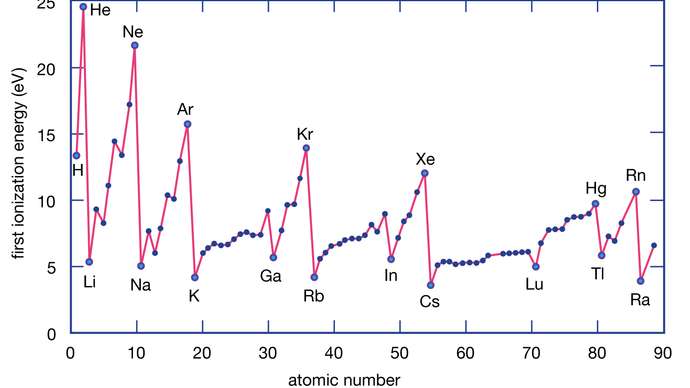
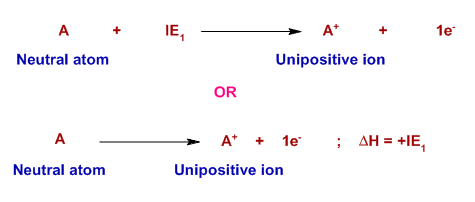
ميزان انرژي لازم براي جداكردن يك الكترون از اتم خنثي انرژي اولين يونش (IE ۱)، انرژي لازم براي جداكردن يك الكترون از يك يون يك بار مثبت گازي و تبديل آن به يون دو بار مثبت را انرژي دومين يونش (IE ۲) ميگويند. همان گونه كه براي اتمها اين انرژي تعريف ميشود ميتوانيم براي مولكولها نيز انرژي يونش را به صورت ميزان انرژي لازم براي جدا كردن الكترون از مولكول در فاز گازي را تعريف كنيم. همان طور كه گفته شد براي كندن الكترون از يك اتم گازي و تبديل آن به يك كاتيون گازي انرژي لازم است، به اين مقدار انرژي، انرژي يونش يا يونيزاسيون ميگويند. به همين ترتيب ميزان انرژي مصرفي براي جداكردن الكترون از يك يون دو بار مثبت گازي و تبديل آن به يون سه بار مثبت گازي را نيز انرژي سومين يونش (IE ۳) ميگويند.
چون در اين عناصر الكترون متمايز كننده به لايههاي داخلي اضافه ميشود و با توجه به اثر پوششي اين الكترونها ميزان اين انرژي قابل توجيه خواهد بود. الكترونها توسط يون مثبت جذب ميشوند و بين آنها نيروي جاذبهاي كه برقرار ميشود باعث ميشود به ميزان انرژي بيشتري احتياج داشته باشيم. در اينجا نيز اين حالتهاي استثنا در تناوبهاي سوم از فسفر به گوگرد و چهارم از آرسنيك به سلنيم نيز صادق، ولي در تناوبهاي پنجم و ششم صادق نيست. در بين اين قوانين منظم تغييرات انرژي در يك دوره و گروه عناصر گروه دوم (فلزات قليايي خاكي) و عناصر گروه ۱۵ (گروه نيتروژن) از اين روند تبعيت نميكند.
انرژي يونش و روند تغييرات انرژي يونش
در يك گروه با افزايش عدد اتمي بار موثر هسته افزايش مي يابد اما اين اثر با افزايش تعداد الكترون هاي داخلي كه اثر پوششي دارند، كاسته مي شود و با افزايش تعداد لايه هاي الكتروني و قرار گرفتن الكترون ها در فاصله دورتري نسبت به هسته الكترون ظرفيت آسان تر جدا مي شود و به انرژي كمتري نياز دارد. به ترتيب در انرژي هاي يونش بعدي بر تعداد بار مثبت كاتيون اضافه شده و ميزان جاذبه بار مثبت و الكترون ها افزوده شده و نيروي دافعه بين الكترون ها كمتر خواهد بود و انرژي مصرفي براي جدا كردن الكترون بالاتر خواهد بود. اين الكترون اضافي نسبت به نيتروژن در يكي از اين اوربيتال ها به صورت جفت شده وجود دارد كه دافعه بين آن ها باعث مي شود انرژي كمتري براي جدا كردن آن ها مصرف شود تا به حالت پايدار سه تايي مثل نيتروژن برسند.
7- انرژي يونش در مولكول ها: همان گونه كه براي اتم ها اين انرژي تعريف مي شود مي توانيم براي مولكول ها نيز انرژي يونش را به صورت ميزان انرژي لازم براي جدا كردن الكترون از مولكول در فاز گازي را تعريف كنيم. ميزان انرژي لازم براي جداكردن يك الكترون از اتم خنثي انرژي اولين يونش (IE1)، انرژي لازم براي جداكردن يك الكترون از يك يون يك بار مثبت گازي و تبديل آن به يون دو بار مثبت را انرژي دومين يونش (IE2) مي گويند. 5- استثنا در روند تغييرات انرژي يونش: در بين اين قوانين منظم تغييرات انرژي در يك دوره و گروه عناصر گروه دوم (فلزات قليايي خاكي) و عناصر گروه 15 (گروه نيتروژن) از اين روند تبعيت نمي كند.
4- روند تغييرات انرژي يونش در جدول تناوبي: با افزايش شعاع اتمي چون فاصله الكترون ها از هسته دورتر مي شود، جدا كردن آن از اتم راحت تر بوده و به ميزان انرژي كمتري مورد نياز است. 1- تعريف انرژي يونش: همان طور كه گفته شد براي كندن الكترون از يك اتم گازي و تبديل آن به يك كاتيون گازي انرژي لازم است، به اين مقدار انرژي، انرژي يونش يا يونيزاسيون مي گويند. انرژي يونش و روند تغييرات انرژي يونش: به مقدار انرژي لازم براي جداكردن سست ترين الكترون از يك اتم در حالت گازي و تبديل آن به يك يون مثبت گازي را انرژي اولين يونش مي گويند. به همين ترتيب ميزان انرژي مصرفي براي جداكردن الكترون از يك يون دو بار مثبت گازي و تبديل آن به يون سه بار مثبت گازي را نيز انرژي سومين يونش (IE3) مي گويند.
پاورپوينت كامل با عنوان خواص تناوبي عناصر در جدول مندليف در 46 اسلايد|دابليو آر
زير لايه آخر كاملتر ميشود و در نتيجه گرفتن يك الكترون براي تكميل كردن لايه آخر، آسانتر از دادن الكترون ميشود. شعاع يك اتم را در مولكولها اندازه ميگيرند و برابر است با نصف فاصله هسته دو اتم در يك مولكول. هر چه پيوند بين اتمها قويتر باشد، انرژي لازم براي شكستن پيوند بيشتر و نقطه ذوب بالاتر است. روند خاصي در جدول تناوبي براي نقطه ذوب وجود ندارد ولي قوانين كلي زير را ميتوان به دست آورد:. استثنا: گازهاي نجيب تمايل به واكنش كمي دارند و كلاً الكترونگاتيوي براي آنها تعريف نميشود. نكته : در يك گروه، هر چه از بالا به پايين حركت كنيم، الكترونگاتيوي اتمها كاهش مييابد.

در همان زمان مندليف توانست بر اساس جدول، خواص برخي از عناصر ناشناخته را هم پيشبيني كند. زيرا فاصله آخرين الكترون از هسته افزايش يافته و پيوند آن با هسته سستتر ميشود. در دو نمودار زير ميبينيد كه در اين دو تناوب، مقدار انرژي يونش همواره صعودي نيست. در اين جدول عناصر شيميايي بر اساس عدد اتمي (تعداد پروتونها) چيده شدهاند. زيرا تعداد پروتونهاي هسته افزايش مييابد ولي لايههاي الكتروني ثابت است. زيرا فاصله الكترون آخر از هسته اتم بيشتر شده و در نتيجه كشش هسته روي آن كمتر است. نكته: در يك گروه، هر چه از بالا به پايين حركت كنيم، شعاع اتمي افزايش مييابد.
انرژي يونش يعني ميزان انرژي لازم براي جدا كردن يك الكترون از اتم در حالت گازي. جدول تناوبي يا جدول مندليف، يكي از مهمترين جداول نوشته شده تاريخ بشر است. نكته : در يك دوره از چپ به راست، الكترونگاتيوي اتمها افزايش مييابند. نكته: در هر گروه، با حركت از بالا به پايين، خاصيت فلزي افزايش مييابد. استثنا: دوره دوم و سوم جدول تناوبي داراي استثنا در مورد انرژي يونش است. نكته: ميتوان انرژي جداسازي دومين و سومين الكترون را هم در نظر گرفت. نكته: در هر گروه با حركت از بالا به پايين، انرژي يونش كاهش مييابد. نقطه ذوب يعني دمايي كه در آن يك ماده از حالت جامد به مايع در ميآيد.
شيــمـي سـلــامـــي/ شيمي دبيرستان
اگر بخواهيم روند تغييرات انرژي نخستين يونش را در هر تناوب از جدول بررسي كنيم ، در هرتناوب در حالي كه لايه انرژي براي عناصر جدول تناوبي واقع در يك تناوب ثابت است با افزايش پروتون هاي هسته ، جاذبه هسته بر الكترون لايه ظرفيت بيشتر شده و در نتيجه شعاع اتمي كاهش مي يابد در نتيجه انرژي لازم براي جدا كردن الكترون بيشتر خواهد بود. روند تغييرات انرژي يونش در يك گروه از جدول تناوبي : در هرگروه از جدول ، با زياد شدن لايه هاي الكتروني و زياد شدن اثر پوششي الكترون هاي دروني ، جاذبه هسته بر الكترون ها كمتر مي شود و از طرفي دافعه الكتروستاتيك الكترون ها بر يكديگر باعث مي شود كه الكترون لايه ظرفيت به راحتي يونش يابد.
+)
در كل در مقايسه انرژي نخستين يونش ، سعي كنيد كه با مقايسه شعاع اتمي انرژي هاي يونش را مقايسه كنيد به طوري كه هر چه شعاع كمتر ، انرژي نخستين يونش بيشتر خواهد بود تا جايي كه مي توان گفت انرژي نخستين يونش ليتيم بر خلاف تصور ظاهري ، كمتر از انرژي نخستين يونش آلومينيم خواهد بود. با اين وجود، هنوز هم مقداري دافعه ي اضافي بين اين دو الكترون وجود دارد كه اين عامل باعث مي شود برداشتن يك الكترون از يك اتم خنثاي اكسيژن، اندكي راحت تر باشد و اين نتيجه با انتظار ما از مؤثر بودن تعداد پروتون هاي هسته ي اتم مطابقت ندارد. ولي آرايش الكتروني اكسيژن : در رسم نموداري آرايش الكتروني آن مي بينيم كه در بين دو الكترون با دافعه وجود داشته و در نتيجه جداكردن الكترون با راحت تر خواهد بود.

اما در تناوب چهارم به دليل اين كه عناصر 21 تا 30 ( اولين سري واسطه هاي خارجي ) در زير لايه d الكترون گيري كرده و درون سازي مي كنند ، مشاهده مي كنيم كه اين بي نظمي در بين كلسيم و گاليم وجود دارد. ذكر يك نكته ديگر ضروري است كه در نقطه B جهش كوچك انرژي رخ خواهد داد كه در نمودار مشخص نشده است ، هر چند كم ولي شيب نمودار در نقطه B بايد از شيب دو نقطه يا الكترون قبل از خود بيشتر باشد. بررسي آرايش الكتروني اتم هاي نيتروژن و اكسيژن نشان مي دهد كه در نيتروژن ، الكترون بايد از يك آرايش الكتروني پايدارتر و متقارن تر بايد جدا شود و اين با صرف انرژي بيشتري همراه است. جهش بزرگ انرژي يونش زماني رخ مي دهد كه لايه انرژي عوض شده و بخواهيم از لايه اي نزديك تر به هسته e جداكنيم كه در اين حالت مجبوريم با صرف انرژي بيشتري عمل يونش الكترون را انجام دهيم.
+E_{1}rightarrow&space;X^{+}(g)+e)
ب ) اگر بخواهيم الكترون را از يك آرايش الكتروني پايدارتر جداكنيم ، اين مي تواند باعث بروز جهش كوچك در انرژي يونش شود ( مثال در اتم اكسيژن كه بين و جهش كوچك انرژي دارد ).
روند تغييرات انرژي يونش در دوره وگروه جدول تناوبي
در يك دوره از چپ به راست انرژي نخستين يونش افزايش مي يابد در يك دوره تعداد لايه هاي الكتروني ثابت است ولي از چپ به راست نيروي جاذبه هسته بر روي الكترون هاي لايه ظرفيت افزايش مي يابد بنابراين الكترونهاي لايۀ ظرفيت با شدت بيشتري توسط هسته جذب مي شوند و جدا كردن الكترون سخت تر خواهد شد. در يك گروه از بالا به پايين تعداد لايه هاي الكتروني افزايش مي يابد بنابراين فاصلۀ هسته تا الكترونهاي لايه ظرفيت بيشتر شده و جدا كردن الكترون از اتم ساده تر خواهد شد يعني انرژي يونش كمتر مي شود. آرايش الكتروني اكسيژن به 3P4 ختم ميشود كه اوربيتال هاي P چهار الكترون دارد و ناپايدار مي باشد و جدا كردن الكترون آسان تر است.

نكته: در بين تمام عناصر هليم كه اولين عنصر گروه ۱۸ است بيشترين IE1 و سزيم Cs كه در پايين گروه يك قرار دارد كمترين انرژي نخستين يونش را دارد. آرايش الكتروني نيتروژن به 3P3 ختم ميشود كه اوربيتالهاي P نيمه پر هستند و پايدار مي باشد و جدا كردن الكترون سخت تراست. در اين پست از سايت جم شيمي به بررسي روند تغييرات انرژي يونش در دوره و گروه جدول تناوبي عناصر مي پردازيم. آرايش الكتروني بريليم Be پايدار است چون در لايه ظرفيت خود 2 الكترون دارد و كاملا پر است4Be : 1S2 / 2S2. اما آرايش الكتروني بور Bبه 3P1 ختم مي شودكه ناپايدار است و جدا كردن الكترون راحت تر است. نكته : در مورد افزايش انرژي نخستين يونش در يك دوره از چپ به راست دو استثناء وجود دارد.
براي مشاهده اين آموزش بخش دوم شيمي دوم دبيرستان به ادامه مطلب مراجعه كنيد. يا چرا انرژي نخستين يونش بور B از بريليم Be كمتر است ؟. 1 ) انرژي نخستين يونش گروه 13 از انرژي نخستين يونش گروه 2 كمتر است ؟. 2) انرژي نخستين يونش گروه 16 از انرژي نخستين يونش گروه 15 كمتر است؟. 5B : 1S2 / 2S2 , 2P1. چون آرايش الكتروني نيتروژن نسبت به اكسيژن پايدار تر است. چون آرايش الكتروني بريليم نسبت به بور پايدار تر است.
منبع
برچسب:
،
ادامه مطلب
بازدید:
![]()